細胞の極性形成に重要な細胞間接着分子の結合メカニズムを解明 -1分子蛍光顕微鏡と高速原子間力顕微鏡で明らかになった2分子間のらせん形結合-
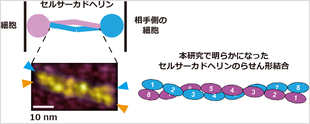
国立大学法人東海国立大学機構 岐阜大学糖鎖生命コア研究所の笠井倫志特任准教授は、大学共同利用機関法人自然科学研究機構 生命創成探究センター (ExCELLS) の西口茂孝特任研究員 (現職: 国立大学法人 大阪大学大学院工学研究科 特任助教) と、ExCELLS/国立大学法人東海国立大学機構 名古屋大学大学院理学研究科の内橋貴之教授のグループと共同で、細胞の極性形成に重要な細胞と細胞をつなぐ細胞間接着分子であるセルサーカドヘリン*1の結合構造をナノメートル (100万分の1ミリメートル) のスケールで可視化することに世界で初めて成功しました。研究グループは、1分子蛍光顕微鏡*2と高速原子間力顕微鏡*3を用いて、セルサーカドヘリン2分子がらせん状に絡み合って結合する結合メカニズムを明らかにしました。セルサーカドヘリンを介した細胞間接着は、体毛の生える方向を決める細胞の極性形成や、脳神経のネットワークの形成等に重要であることから、セルサーカドヘリンの結合メカニズムを解明することで、私たちの複雑なからだの形作りやセルサーカドヘリンの結合障害によって生じる疾患発症の原理解明に繋がることが期待されます。
本研究成果は、国際科学雑誌 「Proceedings of the National Academy of Sciences of the United States of America (米国科学アカデミー紀要)」 (米国東部時間2023年4月24日) に掲載されました。
発表のポイント
- 細胞の極性形成に重要な細胞間接着分子であるセルサーカドヘリンの液中における結合構造を世界で初めて観察した。
- 1分子蛍光顕微鏡と高速原子間力顕微鏡を用いて、セルサーカドヘリンの2分子が逆平行に相対して、らせん状に結合する結合メカニズムを明らかにした。
- セルサーカドヘリンの結合メカニズムを解明することで、私たちの複雑なからだの形作りや、セルサーカドヘリンの結合障害によって生じる疾患発症の原理解明に繋がることが期待される。
詳しい研究内容について
![]() 細胞の極性形成に重要な細胞間接着分子の結合メカニズムを解明
細胞の極性形成に重要な細胞間接着分子の結合メカニズムを解明
-1分子蛍光顕微鏡と高速原子間力顕微鏡で明らかになった2分子間のらせん形結合-
論文情報
- 雑誌名:Proceedings of the National Academy of Sciences of the United States of America
- 論文名:Antiparallel dimer structure of CELSR cadherin in solution revealed by high-speed atomic force microscopy
- 著 者:Shigetaka Nishiguchi*, Rinshi S. Kasai*, Takayuki Uchihashi* (*責任著者)
- DOI番号:10.1073/pnas.2302047120
- 論文公開URL:
 https://www.pnas.org/doi/10.1073/pnas.2302047120
https://www.pnas.org/doi/10.1073/pnas.2302047120
用語解説
- *1) セルサーカドヘリン:
細胞と細胞をつなぐ細胞外領域、細胞膜を貫通する7回膜貫通領域、細胞内領域から構成される。カドヘリンスーパーファミリーおよび接着型Gタンパク質共役受容体に分類され、細胞の極性形成に必須の分子である。相手側の分子と結合することで細胞と細胞をつなぐ。 - *2) 1分子蛍光顕微鏡:
蛍光1分子由来の微弱な蛍光を輝点として検出可能な蛍光顕微鏡。個々の蛍光輝点を識別することで、分子の拡散計数や、相互作用する分子の数、移動量、結合時間等を計測することが出来る。 - *3) 高速原子間力顕微鏡 (高速AFM):
先端の直径が数ナノメートルの針を、観察対象物 (タンパク質等) に接触することで、その表面形状を観察する顕微鏡。溶液中において、観察基板に吸着させた観察対象物を高速 (~10フレーム/秒) でスキャンすることにより、その動きをリアルタイムに画像化することが出来る。











