長期肥満に基づく認知機能障害に小胞体ストレスが関与する
急速に高齢化が進んでいる現在、高齢化に伴う認知症の増加は世界的な課題とされています。運動の習慣、肥満や糖尿病等の生活習慣病の予防、社会的孤立の解消等が、認知症発症を遅らせる(予防の)可能性が示唆されていますが、科学的根拠となるエビデンスは不明のままです。
岐阜大学大学院医学系研究科の中川敏幸教授と再生医科学専攻博士後期課程の中川潔美大学院生らは、アルツハイマー病注1)および肥満モデルマウスを用い、肥満の長期化に伴い海馬において小胞体ストレス注2)が活性化すること、認知機能に重要な海馬神経新生注3)細胞に発現するダブルコルチン注4)mRNAが小胞体ストレス誘導性マイクロRNA注5)により分解されることを確認しました(図)。本研究成果は、自然科学領域を対象としたオープンアクセス電子ジャーナルであるScientific Reportsに、日本時間 2022年1月19日(水)に公開されました。
今回の結果に基づいて、認知症発症の予防法と進行のメカニズムの基礎的研究開発を目指します。
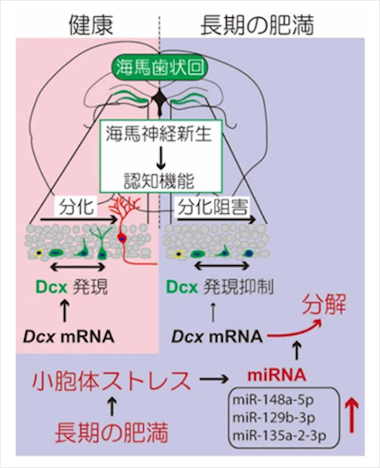
図.研究成果の概要図
発表のポイント
- 高齢者の認知症発症に、運動不足(寄与率:3%)や肥満・糖尿病(各寄与率:1%)が関与することが示唆されていることから、長期の肥満マウスを作製し、海馬神経新生への作用の検討を行い、神経新生細胞の分化に対する長期肥満の作用機構を調べました。
- 長期肥満マウスの認知障害を物体位置認識試験にて解析したところ、移動させた物体の探索時間が有意に短くなり、行動の異常を確認しました。
- 長期肥満マウスの海馬において、小胞体ストレスシグナルの活性化をウエスタンブロットと免疫組織染色にて確認し、未分化神経細胞に特異的に発現するダブルコルチンの神経突起が長期肥満マウスにおいて短いことも確認しました。
- マウス海馬から神経幹細胞を培養し、分化中の細胞に小胞体ストレス刺激を行い、ダブルコルチンの発現を調べると、ダブルコルチンのmRNAが減少することが分かりました。
用語解説
- 注1) アルツハイマー病:
認知症の60-80%を占め、アルツハイマー病脳では神経原線維変化(神経細胞内)とβ-アミロイドが特徴です。β-アミロイドは発症の十数年前から沈着(神経細胞外)すること分かっています。発症初期には、エピソード記憶の障害、無気力やうつ症状も見られることがあります。 - 注2) 小胞体ストレス:
小胞体は、細胞内小器官の一つで細胞質内カルシウム濃度の調節や膜タンパク質と分泌系タンパク質の翻訳・糖鎖修飾に関与しています。合成されたタンパク質はジスルフィド結合により高次構造をとり折りたたまれますが、折りたたみに異常が起こると正常に戻すための三つのシグナルが発信されます。それぞれのシグナルには、PERK、ATF6、IRE1タンパク質が活性化し、翻訳抑制と小胞体シャペロン遺伝子等の発現がみられます。 - 注3) 海馬神経新生:
1955-1963年の核実験(大気圏)に伴う大気中14C(放射性降下物)の急激な上昇により海馬ニューロンにも14Cの取り込みを認めたことから、海馬歯状回の顆粒細胞においてヒトで神経新生を認めることが知られ、ヒトでは1日700個のニューロンが新生(1年間に歯状回ニューロンの1.75%は新生ニューロンに置換)することが分かりました。また、ダブルコルチン免疫組織染色により、アルツハイマー病でダブルコルチン陽性細胞数が減少することが知られています。 - 注4) ダブルコルチン:
微小管結合タンパク質で細胞移動に関与することが示唆されています。X連鎖滑脳症・二層皮質症候群(X-linked lissencephaly and double cortex syndrome)の原因遺伝子として同定され、ダブルコルチン変異雌マウスは海馬機能の障害を示します。 - 注5) マイクロRNA:
ゲノム上にあり、多段階で生成されたタンパク質をコードしない20-25塩基のRNAで、メッセンジャーRNA(mRNA)に結合し、mRNAの分解、翻訳抑制、ポリA鎖分解等により、その遺伝子発現を抑制します。
詳しい研究内容について
![]() 長期肥満に基づく認知機能障害に小胞体ストレスが関与する
長期肥満に基づく認知機能障害に小胞体ストレスが関与する
-認知症発症の危険因子である肥満が海馬神経新生細胞の分化を阻害する機構を報告-
論文情報
- 雑誌名:Scientific Reports, 12,1022, 2022
- 論文名:
Endoplasmic reticulum stress contributes to the decline in doublecortin expression in the immature neurons of mice with long‑term obesity - 著 者:Kiyomi Nakagawa, Saiful Islam, Masashi Ueda, Toshiyuki Nakagawa
- DOI番号:10.1038/s41598-022-05012-5
- 論文公開URL:https://www.nature.com/articles/s41598-022-05012-5
- Shortened URL:https://rdcu.be/cFhKb











