バイオマーカーを見分けて溶けるゲル状物質を開発 ~診断材料や薬物放出材料として期待~
本研究成果は,2014年5月4日(英国時間)に英国科学雑誌「Nature Chemistry」のオンライン速報版で公開されました。
研究のポイント
- バイオマーカーである複雑な生体分子に応答して溶けるヒドロゲルの開発に成功
- 水とゲル化剤と酵素を混ぜるだけで簡単に作製できる
- 簡便で手軽な診断材料や抗体を症状に応じて投与できる薬物放出材料として期待
ヒドロゲル(寒天のように水を固める物質)は生体適合性が高く,さまざまな医療・診断応用が期待され,その高機能化が進められています。しかし,ヒドロゲルが識別できるバイオマーカーはその分子構造が単純なものに限られていました。また,標的とするマーカーごとに応答する新しいゲル化剤(ゲルを形成する化合物)を開発する必要もありました。
本研究グループは,新たなゲル化剤を開発し,ヒドロゲルが特定の化学反応によって溶けるように設計しました。さらに,ゲルの中にその化学反応に必要な酵素を活性を保ったまま埋め込みました。このゲルはたった1種類のゲル化剤から作製できますが,埋め込む酵素を選ぶだけで標的とするバイオマーカー分子も変えることができます。その結果,多様な生体分子(糖尿病や前立腺がん,痛風のバイオマーカー)を識別して溶けるゲルを作製することに成功しました。また,異なる化学反応性を示す2種類のゲル化剤と数種類の酵素を混ぜることによって,複数のバイオマーカーが同時に存在してもしっかり見分けられるヒドロゲルも開発しました。今後,新しいスマートマテリアルとして,診断材料や薬物放出材料の開発などの医療応用に幅広い貢献が期待できます。
本研究は,岐阜大学 工学部 化学・生命工学科の池田 将 准教授(前 京都大学 大学院工学研究科 助教)らと共同で行ったものです。
戦略的創造研究推進事業 チーム型研究(CREST)
研究領域:「プロセスインテグレーションに向けた高機能ナノ構造体の創出」
(研究総括:入江 正浩 立教大学 理学部 教授)
研究課題名:「動的応答特性を有するナノ構造体の構築と精密バイオ機能化」
研究代表者:浜地 格(京都大学 大学院工学研究科 教授)
研究期間:平成20年10月~平成26年3月 JSTはこの領域で,自己組織化に代表される従来の
ボトムアッププロセスに,分子レベルでの精緻な機能を利用して自己構造化や自己修復などの新たな手法を取り込んで一段の高度化を図ることによって新規高機能ナノ構造体の創出を目指しています。
研究の背景と経緯
水を媒体とするヒドロゲルは,その生体適合性の高さから,診断材料,薬物放出担体,細胞培養基材など,さまざまな医療応用が期待される魅力的な材料です。このようなヒドロゲルが特定の分子の存在やその量を識別して溶けたり,再度固まったりできれば,高度な機能を持つ新しい医療材料の開発につながると期待されます。しかし,これまでに開発されたヒドロゲルが識別できる分子は,構造が単純なものに限定されていました。また,識別の対象となる標的分子ごとに新たなゲル化剤の設計と開発が求められ,その都度多大な労力を必要としていました。さらに複数の標的分子が同時に存在するかどうかを見分けるヒドロゲルの開発に関しては,その設計指針さえありませんでした。
研究の内容
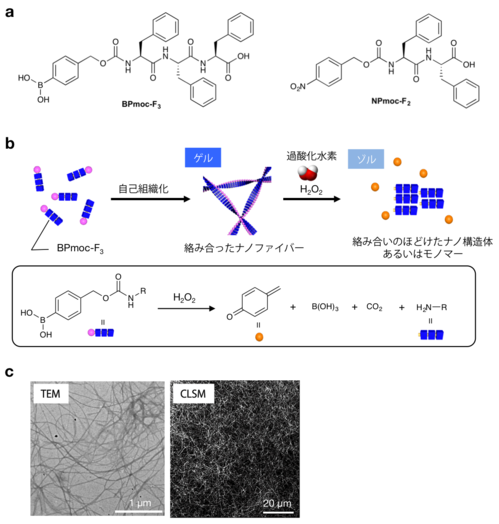
本研究グループは,小分子化合物が自律的に構造を作り出す「自己組織化注1)」という現象によってナノサイズ(ナノは10億分の1)の構造体を開発し,その機能化に取り組んできました。とくに,水中でナノサイズの極細繊維(ナノファイバー)となり,そのナノファイバーが絡み合うことでヒドロゲル(超分子ヒドロゲル)を形成する小分子化合物(ゲル化剤)の高機能化を進め,非常に低濃度でゲル化する化合物の開発に成功してきました(図1)。
今回,それらの知見を基に,酸化反応あるいは還元反応によって溶けるという特徴をもった反応性超分子ヒドロゲルをそれぞれ開発しました(図1a)。
(1) 酸化反応応答型ヒドロゲル
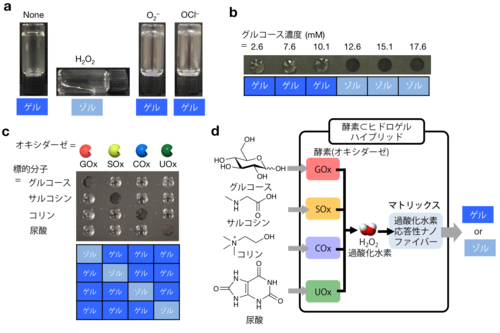
酸化反応によって溶けるヒドロゲルを形成するゲル化剤(BPmoc-F3)は,活性酸素種(ROS)の中で過酸化水素を選択的に見分けて溶けることを明らかにしました(図2a)。過酸化水素は,各種オキシダーゼ(酸化酵素)がその基質を酸化する時に生成することが知られています。そこで,BPmoc-F3が形成するヒドロゲルにいろいろなオキシダーゼを埋め込んだところ,内包したオキシダーゼの基質をヒドロゲルに添加した時にのみゲルが溶けることを見いだしました(図2c)。例えば,グルコースオキシダーゼ(GOx)を内包させたヒドロゲルは,グルコース(ブドウ糖)のみに応答して溶け(図2cの1列目),サルコシンオキシダーゼ(SOx)を内包させたヒドロゲルは,サルコシンのみに応答して溶ける(図2cの2列目)ことを実証しました。この結果は,ヒドロゲルの中でオキシダーゼが十分にその活性を保持し,基質を酸化する際生成した過酸化水素がヒドロゲルを溶かしているということを意味しています(図2d)。つまり,1種類のゲル化剤が形成するヒドロゲルに酵素を選んで混合するだけで,さまざまな生体分子(グルコース(糖尿病のバイオマーカー),サルコシン(前立腺癌のバイオマーカー),尿酸(痛風のバイオマーカー),コリンなど)に応答して溶けるヒドロゲルが作製できることになります。このように多様な生体分子を見分けることのできるヒドロゲルはほかに類をみません。さらに,ヒト血漿を用いた実験では,高血糖症に対応する濃度のグルコースが存在する時だけ溶けるヒドロゲルも作製可能であることを実証しており(図2b),今後,診断材料の開発などの医療応用に幅広い貢献が期待できます。
(2) 還元反応応答型ヒドロゲル
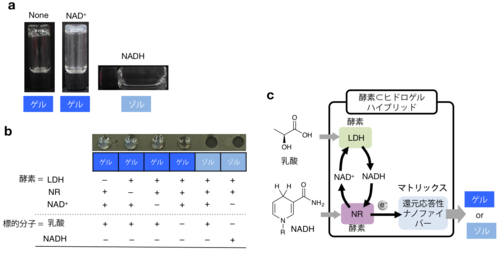
還元反応によって溶けるヒドロゲルを形成するゲル化剤(NPmoc-F2)は,ニトロ還元酵素(NR)注2)と呼ばれる酵素を内包させておくことで,還元型ニコチンアミドアデニンジヌクレオチド(NADH)の存在を選択的に見分けることを明らかにしました(図3a)。NADHは,NAD依存性酵素が基質を酸化する際に酸化型ニコチンアミドアデニンジヌクレオチド(NAD+)から再生されることが知られています。そこで,NAD依存性酵素の1つである乳酸脱水素酵素(LDH)とNAD+とNRを,NPmoc-F2が形成するヒドロゲルに同時に内包させたところ,乳酸を添加した時にヒドロゲルが溶けることを見いだしました(図3b)。この結果は,ゲルの中で乳酸がLDHによって酸化され,その際NAD+から再生されたNADHがゲル化剤と反応し,ヒドロゲルを溶かしていることを示しています(図3c)。ちなみに乳酸はがん組織周辺で濃度が上昇することが知られています。
(3) 酸化反応応答型ヒドロゲルと還元反応応答型ヒドロゲルの複合化
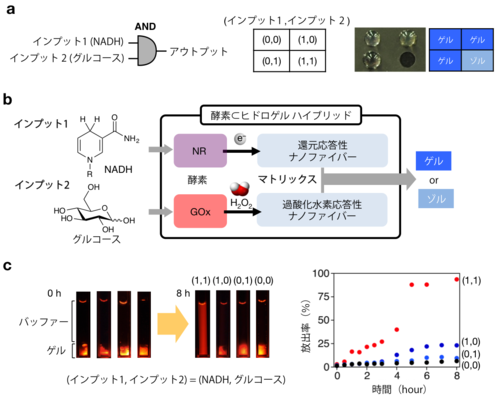
さらに,上記の2種類のゲル化剤および数種類の酵素を混合したヒドロゲルは,それぞれが識別する生体分子が同時に存在する時のみに溶けることも実証しました。すなわち,グルコースのみ,あるいは,NADHのみでは溶けず,グルコースとNADHが両方存在する時においてのみ溶ける自律応答型のヒドロゲルの開発に成功しました(図4)。また,そのヒドロゲルに蛍光色素を修飾した抗体(IgG)を閉じ込めておくと,グルコースとNADHが両方存在する時においてのみ抗体を放出することも明らかにしました(図4c)。
今後の展開
今回開発したヒドロゲルは,水とゲル化剤と酵素を混ぜるだけで簡単に作製できます。さらに抗体のようなバイオ医薬品をそのヒドロゲルのなかに閉じ込めておき,バイオマーカーの存在を識別し放出させることも可能です。
このように,化学反応の特異性を組み込んだ小分子化合物からボトムアッププロセス注3)で作成したナノファイバーからなるヒドロゲルと酵素反応を組み合わせる手法は広く一般化することが可能であり,診断材料,薬物放出材料,再生医療用細胞培養基材など,さまざまな医療材料に「これまでにない自律的に考えて応答するという新たな機能」を付与できると期待されます。
参考図
図1 ゲル化剤の分子構造と自己組織化および化学反応の模式図
(クリックすると拡大します)
a:酸化反応に応答するゲル化剤(BPmoc-F3)と還元反応に応答するゲル化剤
(NPmoc-F2)の分子構造
b:BPmoc-F3の自己組織化および過酸化水素に応答した酸化反応の模式図
c:BPmoc-F3が形成するナノファイバーの顕微鏡写真
(左:透過型電子顕微鏡(TEM)写真,右:共焦点レーザ走査型顕微鏡(CLSM)写真)
図2 酸化反応応答型ヒドロゲル(BPmoc-F3)
(クリックすると拡大します)
a:バイアル瓶中に作成した過酸化水素に選択的に応答するヒドロゲルの写真 (ヒドロゲルはバイアル瓶を逆さにしても流れ落ちないが,過酸化水素を添加後のサンプル(H2O2とラベル:左から2番目)は溶けて(ゾル化し)流れている)。
b:スライドガラス上にスポットしたヒドロゲル(直径約4mm)にグルコースオキシダーゼ(GOx)を内包させ,異なる濃度のグルコースを含むヒト血漿を添加し,水で洗った後のスライドガラスを上から撮影した写真(ヒドロゲルは水で洗ってもスポットとして残っているが,高濃度のグルコースを含むヒト血漿を添加したヒドロゲルは溶けてゾルとなり,洗い流され残っていない)。
c:スライドガラス上にスポットしたヒドロゲル(直径約4mm)にオキシダーゼを内包させ,標的分子を添加し,水で洗った後のスライドガラスを上から撮影した写真(ヒドロゲルは水で洗ってもスポットとして残っているが,溶けたゾルは洗い流され残っていない)。GOx:グルコースオキシダーゼ,SOx:サルコシンオキシダーゼ,COx:コリンオキシダーゼ,UOx:尿酸オキシダーゼ。
d:オキシダーゼを内包したヒドロゲルがそれぞれのオキシダーゼの基質を添加した時に応答することを模式的に示したスキーム。
図3 還元反応応答型ヒドロゲル(NPmoc-F2)
(クリックすると拡大します)
a:バイアル瓶中に作成したNADHに選択的に応答するヒドロゲルの写真(ヒドロゲルはバイアル瓶を逆さにしても流れ落ちないが,NADHを添加後のサンプル(NADHとラベル:右)は溶けて(ゾル化し)流れている)。
b:スライドガラス上にスポットしたヒドロゲル(直径約4mm)に酵素およびNAD+を内包させ,標的分子を添加し,水で洗った後のスライドガラスを上から撮影した写真(ヒドロゲルは水で洗ってもスポットとして残っているが,溶けたゾルは洗い流され残っていない。右から2番目と3番目のスポットを比較すると乳酸を添加することでヒドロゲルが溶けていることが分かる)。LDH:乳酸脱水素酵素,NR:ニトロ還元酵素。
c:LDHとNRとNAD+を内包したヒドロゲルが乳酸あるいはNADHを添加した時に応答することを模式的に示したスキーム。
図4 酸化反応応答型ヒドロゲル(BPmoc-F3)
(クリックすると拡大します)
a:スライドガラス上にスポットした複合化ヒドロゲル(直径約4mm)に,標的分子を添加し,水で洗った後のスライドガラスを上から撮影した写真(ヒドロゲルは水で洗ってもスポットとして残っているが,溶けたゾルは洗い流され残っていない。グルコースとNADHを両方添加したスポット(右下)のみヒドロゲルが溶けていることが分かる。NADHとグルコースをインプット情報としてAND型の論理演算を実行してゲルが溶けていることを意味する結果である)。
b:複合化したヒドロゲルがグルコースおよびNADH両方を添加した時のみ応答することを模式的に示したスキーム。
c:ヒドロゲルに蛍光色素を修飾した抗体を閉じ込めておき,その上にバッファーを加え,さらに,グルコースのみ(0,1),NADHのみ(1,0),グルコースとNADHの両方(1,1),あるいはいずれも含まない(0,0)水溶液を添加し,8時間後に撮影した写真(蛍光を可視化)。ヒドロゲルからバッファー中に放出された抗体の割合(%)の時間変化を蛍光強度から求めたプロット。
用語解説
- 注1)自己組織化
:分子などが非共有結合性相互作用などによって,自分自身で高次の大きな組織や構造を作り出す性質 - 注2)ニトロ還元酵素(NR)
:FMN(フラビンモノヌクレオチド)を補因子とし,ニトロ基を還元する酵素。活性化にNADHを必要とする - 注3)ボトムアッププロセス
:分子や原子といった小さな材料を部品として,その組み合わせから最終的に大きな材料やシステムを作り上げる方法。大きな材料を削る・切るなどして微細に加工し,半導体などの小さな材料を作成するトップダウンアプローチとは反対の方法
論文タイトル
Installing Logic-Gate Response to a Variety of Biological Substances in Supramolecular Hydrogel-Enzyme Hybrids
(超分子ヒドロゲル-酵素ハイブリッドへのさまざまな生体物質に対する論理演算応答の導入)